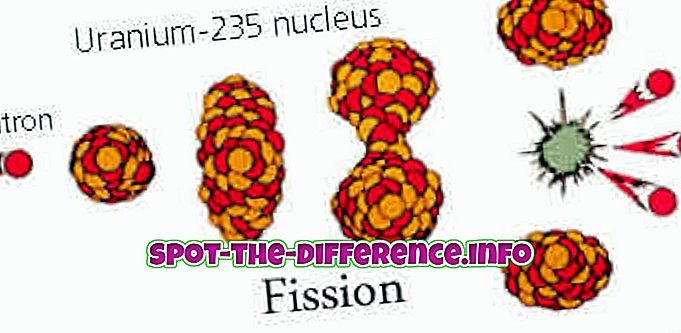
Belangrijkste verschil: in de chemie zijn exotherm en endotherm de twee opvallende typen reacties. Een endotherme reactie vereist warmte (energie). Aan de andere kant is een exotherme reactie die warmte (energie) afgeeft. Beide reacties zijn dus precies tegenovergesteld aan elkaar.
Wanneer moleculen met elkaar interageren, vinden verschillende reacties plaats. Deze reacties zijn gecategoriseerd in vele groepen op basis van hun kenmerken of kenmerken. Twee van deze reacties staan bekend als exotherme en endotherme reacties.

Een van de meest voorkomende voorbeelden van deze reacties is een fotosynthesereactie waarbij planten energie opnemen uit zonlicht en vervolgens koolstofdioxide en water omzetten in zuurstof en suiker. De energie-inhoud van de reactanten is in dit geval minder dan de producten.

De twee reacties kunnen eenvoudig worden begrepen door vergelijkingen. Stel dat na een reactie A-molecuul een B- en C-molecuul vormt. De energie van A blijft groter dan de totale energie van B en C. In dit geval zal de overmatige energie in de omgeving worden afgegeven en de reactie zal worden aangeduid als een exotherme reactie.
A ---> B + C + energie
(reactanten) (producten)
Evenzo kan een endotherme reactie ook worden weergegeven. Laten we aannemen dat A wat energie uit zijn omgeving nodig heeft om het product D te vormen. Wanneer het A-molecuul energie uit de omgeving haalt, wordt die specifieke omgeving kouder na de reactie. Smelten van ijs is een voorbeeld van een endotherme reactie.
A + energie ---> D
(reactanten) (product)
Vergelijking tussen Exotherm en Endotherm:
exothermische | endotherme | |
Definitie | Een exotherme reactie is precies het tegenovergestelde van een endotherme reactie omdat deze warmte produceert. | Een endotherme reactie is dat type reactie dat energie vereist of nodig heeft. Deze energie wordt geleverd vanuit de omgeving. |
Symbolische vergelijking | A -> B + C + energie | A + energie -> D |
Voorbeelden |
|
|
Energie inhoud | Energie-inhoud van de producten is meer dan de reactanten | Het energiegehalte van de reactanten is minder dan de producten |